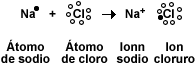La química tiene su propio lenguaje, a lo largo de su desarrollo se han descubierto miles y miles de compuestos y con ellos un gran número de nombres que los identifican .
En la actualidad el número de compuestos sobrepasa los 13 millones, en respuesta a esto, a lo largo de los años los químicos han diseñado un sistema aceptado mundialmente para nombrar las sustancias químicas lo que ha facilitado el trabajo con la variedad de sustancias que existen y se descubren constantemente.
La primera distinción básica en la nomenclatura química, es entre los compuestos orgánicos e inorgánicos donde el primer termino se refiere a la mayoría de aquellos compuestos que contienen el elemento carbono.
La nomenclatura básica para los compuestos inorgánicos. estos compuestos se pueden dividir por conveniencia en cuatro clases o funciones ; oxido, base, ácido y sal.
ELEMENTOS METÁLICOS Y NO METÁLICOS.
Para efectos de nomenclatura y estudio de las propiedades químicas una clasificación muy importante de los elementos es en metálicos y no metálicos.
Se puede determinar aproximadamente si un elemento es metal o no metal por su posición en la tabla periódica , Los metales se encuentran a la izquierda y en el centro de la tabla periódica y los no metales en el extremo a la derecha .
Cuando se comparan dos elementos, el más metálico es el que se encuentra más hacia la izquierda o más hacia la parte inferior de la tabla periódica.
Existen algunas reglas útiles basadas en el concepto del número de oxidación que permiten predecir las fórmulas de un gran número de compuestos.
El estado de oxidación o número de oxidación se define como la suma de cargas positivas y negativas de un átomo, lo cual indirectamente indica el número de electrones que tiene el átomo.
REGLAS:
1. El número de oxidación de cualquier átomo sin combinar o elemento libre por ejemplo;Cl2 es cero.
2. El número de oxidación para oxigeno es -2 ( en los peróxidos es de -1)
3. La suma de los números de oxidación para los átomos de los elementos en una fórmula determinada es igual a cero; cuando se trata de un ion poliatómico es una partícula cargada que contiene más de un átomo , por ejemplo, el nitrógeno es +5.
4. el numero de oxidación para el hidrogeno es +1 ( en los hidruros es de - 1)
5. Para los iones simples, el número de oxidación es igual a la carga de un ión. (Así, para Mg +2 , el numero de oxidación es +2).
CATIONES Y ANIONES
CATIONES ( iones positivos )
Cuando un elemento muestra una simple forma cationica, el nombre del cation es el mismo nombre del elemento.
Ejemplos:
Na+ ion sodio
Ca+2, ion calcio
Al+3, ion aluminio
Cuando un elemento puede formar dos cationes relativamente comunes (con dos estados de oxidación respectivamente diferentes),cada ion debe nombrarse de tal manera que se diferencie del otro. Hay dos maneras de hacer esto, el sistema establecido por la IUPAC y el sistema tradicional.
El SISTEMA ESTABLECIDO POR LA IUPAC; consiste en que los iones positivos se nombran como elemento indicando el número de oxidación mediante numerales entre paréntesis; así, por ejemplo:
Cu +1 es cobre (I) y Cu +2 es cobre ( II)
EL SISTEMA TRADICIONAL; usa los sufijos -oso- e -ico- unidos a la raíz del nombre del elemento para indicar respectivamente, el mas bajo y el mas alto estados de oxidación. Así;
a Cu +1 se le denomina ion cuproso y a Cu +2 ion cúprico ( II).
ANIONES (iones negativos)
Los iones negativos se derivan de los no metales. La nomenclatura de los aniones sigue el mismo esquema de los ácidos , pero cambian las terminaciones como sigue;
Terminación del ácido | Terminación del anión |
| hídrico | uro |
| ico | ato |
| oso | ito |
FUNCIONES QUÍMICAS:
Los compuestos no son fruto de combinaciones al azar de los elementos de la Tabla Periódica, sino que son el resultado de la combinación, en una determinadas proporciones, de elementos que guardan entre sí una cierta “afinidad”.
Estas limitaciones vienen prefijadas por la capacidad de combinación o valencia de los elementos que, a su vez, es función de la estructura electrónica de los átomos implicados.
VALENCIA.
Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos.
La Valencia es un número, positivo o negativo, que nos indica el número de electrones que gana, pierde o comparte un átomo con otro átomo o átomos.
NOMENCLATURAS.
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC (unión internacional de química pura y aplicada).
Se aceptan tres tipos de nomenclaturas para los compuestos inorgánicos, la sistemática, la nomenclatura de stock y la nomenclatura tradicional.
VALENCIAS DE LOS ELEMENTOS MÁS IMPORTANTES DEL SISTEMA PERIÓDICO.
METALES.
| VALENCIA 1 | VALENCIA 2 | VALENCIA 3 |
| Litio Sodio Potasio Rubidio Cesio Francio
Plata | Li Na K Rb Cs Fr Ag | Berilio Magnesio Calcio Estroncio Zinc Cadmio Bario Radio | Be Mg Ca Sr Zn Cd Ba Ra | Aluminio | Al |
| VALENCIAS 1, 2 |
| VALENCIAS 1, 3 |
| VALENCIAS 2, 3 |
|
| Cobre Mercurio | Cu Hg | Oro Talio | Au Tl | Níquel Cobalto Hierro | Ni Co Fe |
| VALENCIAS 2, 4 |
| VALENCIAS 2, 3, 6 |
| VALENCIAS 2, 3, 4, 6, 7 |
|
| Platino Plomo Estaño | Pt Pb Sn | Cromo | Cr | Manganeso | Mn |
NO METALES.
| VALENCIA -1 | VALENCIAS +/- 1, 3, 5, 7 | VALENCIA -2 |
| Flúor | F | Cloro Bromo Yodo | Cl Br I | Oxígeno | O |
| VALENCIAS +/-2, 4, 6 | VALENCIAS 2, +/- 3, 4, 5 | VALENCIAS +/- 3, 5 |
| Azufre Selenio Teluro | S Se Te | Nitrógeno | N | Fósforo Arsénico Antimonio | P As Sb |
| VALENCIAS +/-2, 4 |
| VALENCIA 4 |
| VALENCIA 3 |
|
| Carbono | C | Silicio | Si | Boro | B |
| VALENCIA +/-1 |
|
| Hidrógeno | H |
NOMENCLATURAS.
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC (unión internacional de química pura y aplicada). Se aceptan tres tipos de nomenclaturas para los compuestos inorgánicos, la sistemática, la nomenclatura de stock y la nomenclatura tradicional.
NOMENCLATURA SISTEMÁTICA.
Para nombrar compuestos químicos según esta nomenclatura se utilizan los prefijos: MONO_, DI_, TRI_, TETRA_, PENTA_, HEXA_, HEPTA_ ...

Cl2O3 Trióxido de dicloro
I2O Monóxido de diodo
Nomenclatura sistemática: para nombrar de este modo se usan prefijos numéricos excepto para indicar que el primer elemento de la fórmula sólo aparece una vez (mono) o cuando no puede haber confusión posible debido a que tenga una única valencia. En adelante N.ss
| Prefijos griegos | Número |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| nona- (o eneá) | 9 |
| deca- | 10 |
Ejemplos: CrBr3 tribromuro de cromo ; CO monóxido de carbono
NOMENCLATURA DE STOCK.
En este tipo de nomenclatura, cuando el elemento que forma el compuesto tiene más de una valencia, ésta se indica al final, en números romanos y entre paréntesis:
Fe(OH)2 Hidróxido de hierro (II)
Fe(OH)3 Hidróxido de hierro (III)
Nomenclatura stock: En este caso, cuando el elemento que forma el compuesto tiene más de una valencia atómica, se indica en números romanos al final y entre paréntesis. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro átomo (compuestos binarios).
Ejemplo: Fe2S3 Sulfuro de hierro (III) [se ve la valencia III en el subíndice del azufre.
NOMENCLATURA TRADICIONAL.
En esta nomenclatura para poder distinguir con qué valencia funcionan los elementos en ese compuesto se utilizan una serie de prefijos y sufijos:
•Cuando sólo tiene una valencia se usa el sufijo -ico.
•Cuando tiene dos valencias diferentes se usan (de menor a mayor valencia)
-oso
-ico
•Cuando tiene tres distintas se usan (de menor a mayor)
hipo- -oso
-oso
-ico
•Y cuando tiene cuatro se utilizan (de menor a mayor)
hipo- -oso
-oso
-ico
per- -ico
Ejemplo: Mn2O7 Óxido permangánico
Compuestos inorgánicos: Los compuestos inorgánicos se agrupan en funciones químicas, las cuales se caracterizan por un átomo o grupo de átomos que siempre está presente.

Existen algunos convencionalismos que han sido adoptados para escribir la fórmula de las diferentes funciones químicas:
1. Para escribir la fórmula de los óxidos, ácidos y sales se acostumbra a escribir los símbolos de los elementos de los componentes en orden, según su electronegatividad el más electronegativo siempre va a la derecha, como en los siguientes ejemplos donde el átomo más electronegativo es el O2- y el Cl-:

2. Escribir a la izquierda el ión positivo o catión y a la derecha el ión negativo o anión, como se observa en el siguiente ejemplo:
Los cationes corresponden a elementos metálicos, tienen un número de oxidación positivo (+) y los aniones corresponden a los no metales, con un número de oxidación negativo (-). La carga eléctrica aparece en la parte superior derecha del símbolo y corresponde al número de oxidación de cada elemento. Los números de oxidación permiten escribir las fórmulas químicas, la predicción de las propiedades de los compuestos y son de ayuda en el balanceo de ecuaciones de óxido reducción.
| Cationes |
| Nombre | Símbolo | Nombre | Símbolo |
| Hidrógeno | H+ | Aluminio | Al3+ |
| Litio | Li+ | Cobre (I) o cuproso | Cu+ |
| Sodio | Na+ | Cobre (II) o cúprico | Cu2+ |
| Potasio | K+ | Hierro (II) o ferroso | Fe2+ |
| Calcio | Ca2+ | Hierro (III) o férrico | Fe3+ |
| Magnesio | Mg2+ | Plomo (II) o plumboso | Pb2+ |
| Zinc | Zn2+ | Plomo (IV) o plúmbico | Pb4+ |
| Bario | Ba2+ | Mercurio (I) o mercurioso | Hg+ |
| Plata | Ag+ | Mercurio (II) o mercúrico | Hg2+ |
| Estroncio | Sr2+ |
|
|
| Aniones |
| Nombre | Símbolo |
| Fluoruro | F- |
| Cloruro | Cl- |
| Bromuro | Br- |
| Yoduro | I- |
| Sulfuro | S2- |
| Oxígeno | O2- |
Compuestos inorgánicos binarios: Los compuestos binarios contienen dos elementos distintos y corresponden a las funciones de óxido metálico, óxido no metálico, ácido hidrácido y sal binaria. A continuación se presenta cómo se forma cada una de estas funciones:
Óxido Metálico: se forma al combinarse un metal con el oxígeno.
K+ + O2- = K2O
Óxido No metálico: se forma al combinarse un no metal con el oxígeno.
C4+ + O2- = CO2
Sal Binaria: se forma al combinarse un metal con un no metal:
Na+ + Cl- = NaCl
Ácido Hidrácido: Se forma al combinarse un a molécula de Hidrógeno con un no metal.
H+ + Br- = HBr
ÓXIDOS
Se define un óxido como la combinación binaria de un elemento con el oxígeno.
Con el oxígeno, es corriente que los elementos presenten varios grados de valencia o numero de oxidación, mientras que el O2= siempre es divalente excepto en los peróxidos donde actúa con una valencia de -1.
Para saber la valencia o valencias de un elemento cualquiera con O2 y poder formular el correspondiente óxido, basta con observar su ubicación en la tabla periódica, en la cual el número de la columna indica la valencia más elevada que presenta un elemento para con el O.
Para nombrar los óxidos se utiliza la palabra óxido, seguida del nombre específico del metal, por ejemplo :
Al2O3 Óxido de aluminio
Son compuestos binarios formados por la combinación de un elemento y oxígeno.
Su fórmula general es:
E2OX
Donde E es un elemento y X su valencia (el 2 corresponde a la valencia del oxígeno).
LAS VALENCIAS DEL ELEMENTO Y DEL OXÍGENO SE INTERCAMBIAN Y SE PONEN COMO SUBÍNDICES. Si hay posibilidad de simplificación, ésta se realiza.
Cuando E es un no metal la nomenclatura tradicional los denomina también anhídridos.
Cuando un elemento presenta un número de oxidación variante como por ejemplo el cobre pueden aplicarse diferentes normas como se observa en el siguiente cuadro donde se aplican los 3 sistemas de nomenclatura:
En el sistema Stock se escribe el nombre genérico, en este caso óxido, seguido por la preposición de y el nombre del elemento. Adicionalmente, entre paréntesis se escribe en número romanos el número de oxidación del elemento unido al oxígeno. Si el elemento tiene un solo número de oxidación, se omite el número romano dentro de un paréntesis.

En la nomenclatura sistemática para los óxidos se utiliza el prefijo numeral mono, di, tetra, penta, hexa, etc., para designar el número de oxígenos, seguido de la palabra óxido y el número de átomos del otro elemento.

La nomenclatura tradicional, utiliza los sufijos ico y oso y los prefijos hipo y per de la siguiente manera: si el elemento presenta dos números de oxidación, se utiliza ico para el mayor número de oxidación del elemento que acompaña el oxígeno y oso para el menor. (Observa el ejemplo de la derecha)
Aquí podemos ver algunos ejemplos de fórmulas con su nombre según:
la Nomenclatura Sistemática
la Nomenclatura Stock
la Nomenclatura Tradicional respectivamente:
Na2O
Monóxido de disodio
Óxido de sodio
Óxido sódico
Fe2O2 = FeO
Monóxido de hierro
Óxido de hierro (II)
Óxido ferroso
Ca2O2 = CaO
Monóxido de calcio
Óxido de calcio
Óxido cálcico
Fe2O3
Trióxido de dihierro
Óxido de hierro (III)
Óxido férrico
Br2O5
Pentaóxido de dibromo
Óxido de bromo (V)
Anhídrido brómico
Los óxidos se dividen en dos categorías según sea el tipo del elemento que se combina con el oxígeno .
ÓXIDOS BÁSICOS ( Combinación del oxígeno con elementos metálicos)
Las combinaciones del oxígeno con los metales, se llaman óxidos básicos o simplemente óxidos. El método tradicional para nombrar los óxidos básicos consiste en usar el nombre óxido de seguido de nombre del metal.
EJEMPLO:
Li2O = óxido de litio
CaO = óxido de calcio
Cuando un metal presenta dos números de oxidación diferentes, para designar el óxido se emplean las terminaciones oso ( para el elemento de menor numero de oxidación) e ico ( para el de mayor numero de oxidación).
EJEMPLO:
CoO = óxido cobaltoso
Co2O3 = óxido cobaltico
Para este caso, en el sistema moderno de nomenclatura, recomendado por la IUPAC, el número de oxidación del metal que se combina con el oxígeno se indica con números romanos entre paréntesis agregado al final del nombre del elemento en español.
EJEMPLO:
Co2O = óxido de cobalto ( II)
Co2O3 = óxido de cobalto ( III)
ÓXIDOS ÁCIDOS ( Combinación del oxigeno con elementos no metálicos)
Las combinaciones del oxígeno con los elementos no metálicos se llaman óxidos ácidos o anhidros ácidos.
EJEMPLO:
SiO2 | = | dióxido de silicio |
| SeO2 | = | dióxido de selenio |
Estos óxidos reaccionan con el agua para dar ácidos ( tipo oxácido)
| CO2 | + | H2O | → | H2CO3 | ácido carbónico |
| oxido ácido |
|
|
| oxácido |
|
Para nombrar estos compuestos, la IUPAC recomienda el uso de la palabra óxido y los prefijos griegos; mono, di tri, tetra, etc. que indican el numero de átomos de cada clase en la molécula.
TeO2 = dióxido de telurio
TeO3 = trióxido de telurio
As2O3 = trióxido de diarsenico
As2O5 = pentaóxido de diarsenico
| 2Cl2 | + | O2 | → | Cl2O | = monóxido de dicloro |
|
|
| oxido ácido |
|
Cuando un elemento presenta dos valencias diferentes, se usa la terminación oso para el oxido que tiene el elemento de menor valencia y la terminación ico para el de menor valencia:
| TeO2 = oxido teluroso | TeO3 = oxido telúrico |
Sin embargo, el mejor método y el que ofrece manos confusión es el de la IUPAC o sistema Stock, donde el numero de oxidación o valencia se indica con números romanos entre paréntesis. Para los óxidos de los halógenos todavía se usan los prefijos hipo y per combinados con los sufijos oso e ico.
| 2N2 | + | 3O2 | → | 2N2O3 | = óxido de nitrógeno (III) |
|
|
| oxido ácido |
|
| 2Cl2 | + | O2 | → | 2Cl2O | = óxido hipocloroso |
|
|
| oxido ácido |
|
| 2Cl2 | + | 7O2 | → | 2Cl2O7 | = óxido perclórico |
|
|
| oxido ácido |
|
BASES O HIDRÓXIDOS
Según la definición de Bronsted - Lowry, una base es cualquier sustancia que puede aceptar reaccionar con un ion hidrogeno .
Se entiende por hidróxido cualquier compuesto que tiene uno o mas iones hidróxido remplazables (OH-) .
Las bases se obtienen por la reacción de los óxidos metálicos con el agua.
EJEMPLO:
| Na2O | + | H2O | → | 2NaOH | = hidróxido de sodio |
Al2O3 + 3H 2O → 2Al(OH) 3 = hidróxido de alumínio
Como el grupo hidroxilo es monovalente, para formular una base se añade al metal que lo forma, tantos iones OH- como indica la valencia del metal. Las bases se nombran con las palabra hidróxido de seguidas del nombre del metal.
Cuando un elemento presenta dos estados de oxidación diferentes como ya se vio , el nombre termina en oso en los compuestos en que el elemento tiene la menor valencia y en ico en los que el elemento tienen la mayor valencia.
 EJEMPLO:
EJEMPLO:
| Ni(OH)2 = hidróxido niqueloso | Ni (OH)3 = hidróxido niquelico |
Función hidróxido o base: Se forman por la combinación de un ión (OH-) con un catión metálico. Los iones (OH-) son llamados oxidrilos, hidroxilos o hidróxidos.
Los hidróxidos provienen de reacciones entre un óxido metálico con el agua dando origen a una base constituida por un metal y el grupo hidroxilo.

La nomenclatura Stock, utiliza el nombre genérico (hidróxido) y el nombre del metal, colocando adicionalmente entre paréntesis en números romanos el número de oxidación del elemento unido al OH-, cuando se trata de elementos con más de un número de oxidación. Esto se omite cuando el elemento tiene un solo número de oxidación.

El sistema tradicional comienza con el nombre del hidróxido y luego va la terminación oso si se trata del menor número de oxidación e ico si se trata del mayor número de oxidación. Si el elemento tiene un solo número de oxidación, simplemente se utiliza el número del metal.

La nomenclatura sistemática utiliza los prefijos di, tri, tetra, etc., si la fórmula presenta dos, tres o cuatro grupos OH- respectivamente y así sucesivamente en caso de presentar más. Las normas sistemáticas establecidas por la IUPAC vienen recomendándose para su aplicación a fin de sustituir progresivamente al sistema de nomenclatura tradicional.

ÁCIDOS
Un ácido se puede describir como una sustancia que libera iones hidrogeno (H+) cuando se disuelve en agua: Las formulas de los ácidos contienen uno o mas átomos de hidrogeno, así como un grupo aniónico.
Según la definición de Bronsted -Lowry, ácido es toda sustancia capaz de ceder protones,(H+).
En las formulas de todos los ácidos el elemento hidrogeno se escribe en primer lugar. Hay dos clases de ácidos;
(a) HIDRÁCIDOS:
Que no contienen oxígeno. Son ácidos binarios formados por la combinación del hidrogeno con un elemento no metal.
Se nombran empleando la palabra genérica ácido seguida del nombre en latín del elemento no metálico con la terminación hídrico. A los hidrácidos se les considera como los hidruros de los elementos de los grupos Vi y VII.
EJEMPLOS:
| H2S | ácido sulfhídrico |
| HI | ácido yodhídrico |
| HBr | ácido bromhídrico |
| HF | ácido fluorhídrico |
| HCl | ácido clorhídrico |
Función hidrácido: Estos ácidos se forman por la combinación de los halógenos (F, Cl, Br, I) o el azufre (S) con el Hidrógeno.
H2 + Halógenos o azufre = ácido Hidrácido
Para nombrar a estos compuestos se antepone la palabra ácido, luego el nombre específico del no metal y sustituyendo la última vocal del compuesto por el sufijo hídrico.
|
| H+ |
|
| F- | HF | Ácido fluorhídrico |
| Cl- | HCl | Ácido clorhídrico |
| Br- | HBr | Ácido Bromhídrico |
| I- | HI | Ácido iodhídrico |
| S2- | H2S | Ácido sulfhídrico |
RECUERDE QUE ; HX ( X= F, Cl; Br, I ) en estado gaseoso no es un ácido; en agua se disocia para producir iones H+, su solución acuosa se llama ácido.
EJEMPLO:
| HCl(g) + H2O(l) | → | HCL(ac) |
| Cloruro de hidrogeno |
|
| ácido clorhídrico |
b) OXÁCIDOS
Que contienen oxígeno. Son ácidos ternarios que resultan de la combinación de un oxido ácido con el agua; por tanto, son combinaciones de hidrógeno, oxigeno y un no metal.
EJEMPLO:
| PO3 | + | H2O | → | H3PO3 | = ácido fosforoso |
| PO4 | + | H2O | → | H3PO4 | = ácido fosfórico |
Los oxácidos se nombran como los anhídridos u óxidos de donde provienen. La fórmula general de los oxácidos u oxácidos es:
( HO)mXOn
donde m es el numero de grupos OH enlazados covalentemente al central X y n es el numero de oxígenos enlazados covalentemente a X
Función ácido oxácido: Están formados por un catión H+ unido a un ión poliatómico (radical) negativo. Los ácidos oxácidos se forman a partir de la combinación de los óxidos metálicos con el agua.

La nomenclatura Stock adiciona la palabra ácido, el prefijo respectivo según la cantidad de oxígeno (Di, Tri, Tetra, etc), seguido de la palabra oxo y la raíz del nombre correspondiente del elemento no metálico diferente del hidrógeno y del oxígeno con la terminación ico y su número de oxidación en números romanos.

Para determinar el número de oxidación en los oxácidos se siguen los siguientes pasos:
1. Se escriben números de oxidación conocidos, que no varían: 1+ HClxO42-
en este caso del hidrógeno y del oxígeno. El número del cloro es el desconocido (x) puesto que puede variar.
2. Se multiplican los subíndices por el número de oxidación de los elementos que no varían:

4. Se despeja: X= 8 – 1 = 7
7 es el número de oxidación del cloro, porque la suma de las cargas iónicas es igual a cero, equivale a decir que tiene que haber tantas cargas positivas como negativas.
Por eso el HClO4 parece en la nomenclatura Stock con un número VII para indicar el número de oxidación del cloro.
En la nomenclatura sistemática se da el nombre del ión y luego se complementa con la expresión de hidrógeno.
En la nomenclatura tradicional se el compuesto se nombrará con la palabra ácido y se hace uso de los sufijos oso o ico y de los prefijos hipo o per, si existen más de dos oxácidos de ese elemento.

| Valencia del Cloro | Compuesto | Nomenclatura |
| +1 | HClO | Ácido hipocloroso |
| +3 | HClO2 | Ácido cloroso |
| +5 | HClO3 | Ácido clórico |
| +7 | HClO4 | Ácido perclórico |
SALES
Una sal es el producto de la reacción entre un ácido y una base: en esta reacción también se produce agua: en términos muy generales, este tipo de reacción se puede escribir como :
BASE + ÁCIDO → SAL + AGUA

Se observa que el ácido dona un H+ a cada OH- de la base para formar H2O y segundo que la combinación eléctricamente neutra del ion positivo Na+, de la base y el ion negativo del ácido, Cl-, es lo que constituye la sal.
Es importante tener en cuenta que el elemento metálico, Na+, se escribe primero y luego el no metálico, Cl-.
También se considera una sal a el compuesto resultante de sustituir total o parcialmente los hidrógenos ( H+) de un ácido por metales: las sales se dividen en sales neutras, sales haloideas o haluros, oxisales , sales ácidas y sales básicas.
SALES NEUTRAS
Resultan de la sustitución total de los hidrógenos ( H+) por un metal. El nombre que recibe la sal se deriva del ácido del cual procede; las terminaciones cambian según la siguiente tabla ;
| NOMBRE DEL ÁCIDO | NOMBRE DE LA SAL |
| __________________hídrico | __________________uro |
| hipo_______________oso | hipo________________ito |
| __________________ oso | ___________________ito |
| __________________ ico | ___________________ato |
| per________________ico | per________________ ato |
Se da primero el nombre del ion negativo seguido del nombre del ion positivo.
| FeCl2 = cloruro ferroso | FeCl3 = cloruro férrico |
Sin embargo para este caso el esquema de nomenclatura de la IUPAC, que se basa en un sistema ideado por A Stock, indica el estado de oxidación del elemento mediante un numero romano en paréntesis a continuación del nombre del elemento así;
Ejemplo:
| FeCl2 = cloruro de hierro ( II) | FeCl3 = cloruro de hierro (III) |
Si el elemento metálico forma un ion de un solo estado de oxidación no se usa numero romano ejemplo;
LiI = Yoduro de Litio
Sales neutras: se forman al reemplazar los hidrógenos catiónicos de los ácidos por elementos metálicos.

Nomenclatura de las sales neutras: El nombre que recibe una sal neutra deriva del ácido del cual se origina, cambiando sus terminaciones como se indica en la tabla.
| Nombre del Ácido | Nombre de la sal neutra |
| Ácido Hipocloroso | Hipo -ito |
| -oso | -ito |
| -ico | -ato |
| Per -ico | Per -ato |

SALES HALOIDEAS O HALUROS
Se forman por la combinación de un hidrácido con una base. En la formula se escribe primero el metal y luego el no metal (con la menor valencia) y se intercambian las valencias). Los haluros se nombran cambiando la terminación hidrico del ácido por uro y con los sufijos oso e ico, según la valencia del metal.
EJEMPLO;
| Cu(OH) + HCl | → | CuCl | + H2O |
|
| ácido clorhídrico
|
| cloruro cuproso
|
|
| 2Fe(OH)3 + H2S | → | Fe2S 3 | + 6H2O |
|
| ácido sulfhídrico
|
| sulfuro férrico |
|
Si un par de no metales forman más de un compuesto binario, como es el caso más frecuente, para designar el número de átomos de cada elemento En este el estado de oxidación del elemento se usan los prefijos griegos: bi: dos, tri: tres, tetra: cuatro, penta: cinco, hexa: seis, etc, antecediendo el nombre del elemento, por ejemplo;
PS3 = trisulfuro de fósforo PS5 = pentasulfuro de fósforo
OXISALES
Se forman por la combinación de un oxácido con una base.
En la formula se escribe primero el metal, luego el no metal y el oxigeno. Al metal se le coloca como subíndice la valencia del radical (parte del oxácido sin el hidrogeno) que depende del numero de hidrógenos del ácido.
Las oxisales se nombran cambiando la terminación oso del ácido porito e ico por ato.
Ejemplo;
| KOH + HClO | → | KClO | + H2O |
|
| ácido hipocloroso
|
| hipoclorito de sodio
|
|
| Al(OH)3 + HNO3 | → | Al(NO3)3 | + H2O |
|
| ácido nítrico
|
| nitrato de aluminio
|
|
SALES ÁCIDAS
Resultan de la sustitución parcial de los hidrógenos del ácido por el metal. en la formula se escribe primero el metal, luego el hidrogeno y después el radical.
EJEMPLO:
| NaOH + H2CO3 | → | NaHCO3 | + H2O |
|
| ácido carbónico
|
| carbonato ácido de sodio ( Bicarbonato de sodio)
|
|
Sales ácidas: se forman cuando los elementos metálicos no reemplazan la totalidad de los hidrógenos catiónicos.

SALES BÁSICAS
Resultan de la sustitución parcial de los hidróxidos (OH) de las bases por no metales. En la formula se escribe primero el metal, luego el OH y finalmente el radical.
EJEMPLO:
CuOHNO3 = nitrato básico de cobre (II)
Se aplican las reglas generales para nombra oxisales, pero se coloca la palabra básica entre nombre del radical y el metal.
EJEMPLO:
| Cu(OH)2 + HNO3 | → | CuOHNO3 | + H2O |
|
| ácido nitrico
|
| nitrato básico de cobre (II)
|
|
SALES DOBLES
Se obtienen sustituyendo los hidrógenos de ácido por mas de un metal. en la formula se escribe los dos metales en orden de electropositividad y luego el radical. Se da el nombre del radical seguido de los nombres de los metales respectivos.
EJEMPLO:
| Al(OH)3 + KOH + H2SO4 | → | KAl(SO4) | + H2O |
|
| ácido sulfurico
|
| sulfato de aluminio y potasio ( alumbre)
|
|
Sales dobles: se forman cuando más de un elemento metálico (catión) sustituye a los hidrógenos del ácido.

Compuestos ternarios: Estos compuestos están formados por 3 elementos químicos: un catión (H2 o un no metal) un ión negativo poliatómico que corresponde a las funciones de hidróxido o base, ácido oxácido y una sal ternaria neutra.
Para dar el nombre al compuesto ternario se menciona primero el grupo poliatómico (radical) negativo y en seguida se menciona el nombre del catión. Para nombrar estos compuestos es necesario conocer el nombre de los iones poliatómicos.
PERÓXIDOS
En el agua ordinaria, H2O, el oxigeno tiene un numero de oxidación de -2. en el agua oxigenada , H2O2, el número de oxidación del oxigeno es -1. el ion O2= se llama ion peroxido.
Los peróxidos resultan de sustituir los dos hidrógenos del agua oxigenada por elementos metálicos.
Se nombran con la palabra peróxido seguida del correspondiente metal.
EJEMPLO:
| Na2O2 = peróxido de sodio | Ba2O2 = peróxido de bario |
HIDRUROS
La combinación de cualquier elemento con el hidrogeno constituye un hidruro. el hidrogeno es siempre monovalente y en el caso de los hidruros metálicos presenta un estado de oxidación de -1 ( en los demás casos aparece como +1).
Para saber la valencia que tiene un elemento cualquiera, al combinarse con el hidrogeno para formar el correspondiente hidruro, basta con observar la tabla periódica y tener en cuenta las siguientes reglas;
1. Los elementos de las tres primeras columnas, presentan con el Hidrogeno la valencia que indica el numero de la columna; así: primera columna= monovalentes, segunda columna= divalentes, tercera columna= trivalentes.
2. Para saber la valencia con el hidrogeno de los elementos de las columnas IV a VIII, se resta de 8 el numero característico de la columna que ocupa el elemento, Así, los elementos de la columna V serán trivalentes porque 8-5 = 3-
En cuanto a la nomenclatura, los hidruros formados por los metales reciben el nombre ; Hidruro de ... ( nombre del elemento combinado por el H). Los hidruros de los no metales reciben nombres especiales.
EJEMPLO:
| NaH | = | hidruro de sodio |
| NH3 | = | amoniaco |
| CoH3 | = | hidruro de cobalto |
| PH3 | = | fosfina |
Una base es, en primera aproximación, cualquier sustancia que en disolución acuosa aporta iones OH- al medio. Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
KOH → OH- + K+ (en disolución acuosa)
Se denomina ácido a cualquier compuesto químico que disuelto en agua, da una solución con un pH menor de 7.
Cualquier compuesto químico que puede ceder protones es un ácido. Un ejemplo es el ácido clorhídrico, de fórmula HCl:
HCl → H+ + Cl- (en disolución acuosa)
El concepto de ácido es el contrapuesto al de base. Para medir la acidez de un medio se utiliza el concepto de pH.
En química, una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa). Son el producto típico de una reacción química entre una base y un ácido, la base proporciona el catión y el ácido el anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y una base (hidróxido) origina una sal más agua, lo que se denomina neutralización.
Un ejemplo es la sal de mesa, denominada en el lenguaje coloquial sal común, sal marina o simplemente sal. Es la sal específica cloruro sódico. Su fórmula química es NaCl y es el producto de la base hidróxido sódico(NaOH) y ácido clorhídrico, HCl.
En general, las sales son compuestos iónicos que forman cristales. Son generalmente solubles en agua, donde se separan los dos iones. Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad. Fundidos o disueltos en agua, conducen la electricidad.