Desde los primeros tiempos, los seres humanos han observado la transformación de las sustancias (la carne cocinándose, la madera quemándose, el hielo derritiéndose) y han especulado sobre sus causas. Siguiendo la historia de esas observaciones y especulaciones, se puede reconstruir la evolución gradual de las ideas y conceptos que han culminado en la química moderna.
Química (del griego χημεία khemeia que significa "alquimia") es la Ciencia Natural que estudia la materia, su estructura, propiedades y transformación de la misma a nivel atómico, molecular y macromolecular.
La ubicuidad de la química en las ciencias naturales hace que sea considerada la Ciencia Central. La química es de importancia en muchos campos del conocimiento, como la física , la ciencia de materiales , la biología , la medicina, la geología y la astronomía entre otros.

Antoine Lavoisier. Considerado el creador de la química moderna.
Como ejemplos de reacciones químicas tenemos:
- El resultado de la colisión de una partícula alfa con el núcleo de un átomo, un átomo o molécula.
- La colisión de un neutrón libre con un núcleo atómico inestable. (Fisión Nuclear)
- La formación de moléculas o iones a partir de la colisión de dos átomos.
- La fragmentación, ionización o cambio de estructura de una molécula después de ser irradiada con luz.
- La adsorción de un átomo o molécula sobre una superficie.
- El flujo de electrones entre dos sólidos en contacto.
- El cambio estructural en una proteica ante el estímulo apropiado.
Aunque hay una gran variedad de ramas de la química, las principales divisiones son:
- Química General
- Química Aplicada
- Química Especial
- General: Estudia las propiedades comunes de todos los cuerpos y las leyes que rigen los fenómenos químicos.
- Aplicada: Estudia las propiedades de cada una de las sustancias en particular. Esta a su vez se divide en:
- Inorgánica
- Orgánica
- Especial: Comprende diversos estudios, las principales son:
- Química Técnica
- Bioquímica
- Electroquímica.

Friedrich Kekulé
La Bioquímica es la rama de la Química que estudia los seres vivos, especialmente de la estructura y función de sus componentes químicos específicos, como son las proteínas, carbohidratos , lípidos y ácidos nucléicos, además de otras pequeñas moléculas presentes en las células. La bioquímica se basa en el concepto de que todo ser vivo contiene carbono y en general están compuestos de carbono, oxígeno hidrógeno, nitrógeno, fósforo y azufre.
La electroquímica es una rama de la química que estudia las reacciones que toman lugar en la interfase de un conductor eléctrico, donde el electrodo está compuesto de un metal o un semiconductor, (incluyendo el grafito) y un conductor iónico (el electrolito).
Campo de trabajo de la Química: El átomo.
Los orígenes de la teoría atómica se remontan a la Grecia antigua, a la escuela filosófica de los atomistas. La base empírica para tratar a la teoría atómica de acuerdo con el método científico se debe a un conjunto de trabajos aportados por Lavoiser, Proust, Richter, Dalton, Gay-Lussac y Avogadro; entre otros, hacia principios del siglo XIX.
El átomo es la menor fracción de materia de interés directo para la química, está constituido por diferentes partículas que poseen diferentes tipos de cargas, los electrones con carga negativa, los protones con carga positiva y los neutrones que como su nombre indica son neutros (sin carga); todos ellos aportan masa para contribuir al peso del átomo.
Química.Conceptos fundamentales.
Partículas
Los átomos son las partes más pequeñas de un elemento (como el carbono,el hierro o el oxígeno). Todos los átomos de un mismo elemento tienen la misma estructura electrónica (responsable esta de la gran mayoría de las características químicas), pudiendo diferir en la cantidad de neutrones (isótopos). Las moléculas son las partes más pequeñas de una sustancia (como el azucar ), y se componen de átomos enlazados entre sí. Si tienen carga eléctrica, tanto átomos como moléculas se llaman iones: Cationes si son positivos, aniones si son negativos.
El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a 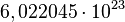 . Se dice que 12 gramos de carbono, o un gramo de hidrógeno, o 56 gramos de hierro, contienen aproximadamente un mol de átomos (la masa molar de un elemento está basada en la masa de un mol de dicho elemento). Se dice entonces, que el mol es una unidad de cambio.
. Se dice que 12 gramos de carbono, o un gramo de hidrógeno, o 56 gramos de hierro, contienen aproximadamente un mol de átomos (la masa molar de un elemento está basada en la masa de un mol de dicho elemento). Se dice entonces, que el mol es una unidad de cambio.
1 mol de glucosa equivale a 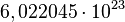 moléculas de glucosa
moléculas de glucosa
1 mol de Uranio equivale a 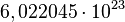 átomos de Uranio
átomos de Uranio
Dentro de los átomos, podemos encontrar un núcleo atómico y uno o más electrones. Los electrones son muy importantes para las propiedades y las reacciones químicas. Dentro del núcleo se encuentran los neutrones y los protones. Los electrones se encuentran alrededor del núcleo. También se dice que es la unidad básica de la materia con características propias. Está formado por un núcleo donde se encuentran protones.
Dentro de los átomos, podemos encontrar un núcleo atómico y uno o más electrones. Los electrones son muy importantes para las propiedades y las reacciones químicas. Dentro del núcleo se encuentran los neutrones y los protones. Los electrones se encuentran alrededor del núcleo. También se dice que es la unidad básica de la materia con características propias. Está formado por un núcleo donde se encuentran protones.El núcleo atómico es la parte central de un átomo donde se concentra prácticamente la totalidad de su masa.
Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte. La cantidad de protones en el mismo determina el elemento químico al que pertenece.Los enlaces son las uniones entre átomos para formar moléculas. Siempre que existe una molécula es porque ésta es más estable que los átomos que la forman por separado. A la diferencia de energía entre estos dos estados se le denomina energía de enlace.
La energía de enlace es la energía que se desprendería por la formación de un enlace químico, a partir de sus fragmentos constituyentes. Los enlaces más fuertes, o más estables, tienen una energía de enlace grande. Los enlaces covalentes, metálicos o iónicos son típicamente muy fuertes, frente a los de puente de hidrógeno o Van der Waals típicamente más débiles.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequiometría.
Orbitales:
Para una descripción y comprensión detalladas de las reacciones químicas y de las propiedades físicas de las diferentes sustancias, es muy útil su descripción a través de orbitales, con ayuda de la química cuantica.Un orbital atómico es una función matemática que describe la disposición de uno o dos electrones en un átomo. Un orbital molecular es análogo, pero para moléculas.
Los orbitales son funciones matemáticas para describir procesos físicos: un orbital solo existe en el sentido matemático, como pueden existir una suma, una parábola o una raíz cuadrada. Los átomos y las moléculas son también idealizaciones y simplificaciones: un átomo sólo existe en vacío (es la falta de contenido de un objeto, que tiene nada en su interior), una molécula sólo existe en vacío, y, en sentido estricto, una molécula sólo se descompone en átomos si se rompen todos sus enlaces. En el "mundo real" sólo existen los materiales y las sustancias.Disoluciones:
En agua, y en otros disolventes (como la acetona o el alcohol), es posible disolver sustancias, de forma que quedan disgregadas en las moléculas o iones que las componen (las disoluciones son transparentes). Cuando se supera cierto límite, llamado solubilidad, la sustancia ya no se disuelve, y queda, bien como precipitado en el fondo del recipiente, bien como suspensión, flotando en pequeñas partículas (las suspensiones son opacas o traslúcidas).
Se denomina concentración a la medida de la cantidad de soluto por unidad de cantidad de disolvente.
Acidez:El pH es una escala logarítmica para describir la acidez de una disolución acuosa. Los ácidos, como el jugo de limón y el vinagre, tienen un pH bajo (inferior a 7). Las bases, como la soda o el bicarbonato de sodio, tienen un pH alto (superior a 7).
El pH se calcula mediante la siguiente ecuación:
donde  es la actividad de iones hidrógeno en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrógeno de
es la actividad de iones hidrógeno en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrógeno de ![[H^+]\,](http://upload.wikimedia.org/math/1/e/f/1ef3bcce90c20f8119eebc5d3fa164a5.png) que cede el ácido a la solución.
que cede el ácido a la solución.
- una solución neutral (agua ultra pura) tiene un pH de 7, lo que implica una concentración de iones hidrógeno de 10-7 M.
- una solución ácida (por ejemplo, de ácido sulfúrico) tiene un pH <>-7 M.
- una solución básica (por ejemplo, de hidróxido de potasio) tiene un pH > 7, o sea que la concentración de iones hidrógeno es menor que 10-7 M.
Formulación y nomenclatura:
La IUPAC (Unión Internacional de Química Pura y Aplicada), un organismo internacional, mantiene unas reglas para laformulación y nomenclatura química. De esta forma, es posible referirse a los compuestos químicos de forma sistemática y sin equívocos.
Mediante el uso de fórmulas químicas es posible también expresar de forma sistemática las reacciones químicas, en forma de ecuación química.
Formulación química es la disciplina que regula las convenciones a emplear en la utilización de fórmulas químicas. Una fórmula química se compone de símbolos y subíndices, correspondiéndose los símbolos con los de los elementos que formen el compuesto químico a formular y los subíndices con las necesidades de átomos de dichos elementos para alcanzar la estabilidad molecular. Así, sabemos que una molécula descrita por la fórmula H2SO4 posee dos átomos de Hidrógeno, un átomo de Azufre y 4 átomos de Oxígeno.
Materia.En física, la materia es aquello de lo que están hechos los objetos que constituyen el Universo observable. Si bien durante un tiempo se consideraba que la materia tenía dos propiedades que juntas la caracterizan: que ocupa un lugar en el espacio y que tiene masa, en el contexto de la física moderna se entiende por materia cualquier campo, entidad o discontinuidad que se propaga a través del espacio-tiempo a una velocidad inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
Todos los cuerpos están formados por materia, cualquiera sea su forma, tamaño o estado. Pero no todos ellos están formados por el mismo tipo

La materia viva llamada también materia orgánica, esta formada principalmente por carbono, hidrógeno, oxígeno y nitrógeno. Estos elementos, al combinarse, forman sustancias que interactúan entre si dentro de la forma viva mas simple que es la célula.
En conclusión, la materia, es todo aquello que nos rodea, todo lo que el hombre estudia, puede ser tan dura como el diamante o tan blanda como la plastilina, tan grande como un planeta o tan pequeña como una bacteria. Concluyendo se puede decir que todo lo que constituye el Universo es materia.
Durante mucho tiempo el concepto materia y masa se tomaron como sinónimos; sin embargo a principios del siglo XX Albert Einstein, demostró en su ecuación que la masa y la energía son dos componentes de la materia, pudiéndose interconvertir una en la otra.
Propiedades de la Materia.
Para poder estudiar y entender que es la materia y como se comporta es necesario estudiar sus propiedades. Las cuales se clasifican como: generales ó extensivas y específicas ó intensivas.
Propiedades generales de la materia o extensivas.
Son aquellas propiedades de un cuerpo cuyo valor medible depende de la cantidad de masa, ejemplos: volumen, peso, número de moles, inercia, porosidad.
Estas propiedades las presentan todos los cuerpos, por lo que no se emplean para diferenciar una sustancia de otra.
- Volumen: Es el espacio que ocupa un cuerpo, se determina por tres coordenadas tridimensionales. L x A x G, largo x ancho x grueso.
- Peso:Es la fuerza de atracción de la tierra sobre un cuerpo, se mide mediante un dinamómetro. Sus unidades son el kilogramo-fuerza (Kgf).
- Inercia: Es el estado de reposo o movimiento nulo de un cuerpo.
- Porosidad: Es el espacio que existe entre las moléculas de un cuerpo, son los huecos entre las moléculas.
- Número de moles: Es una medida de la cantidad de partículas de un cuerpo numéricamente es igual al número de Avogadro 6.023x1023 átomos o moléculas para un elemento o un compuesto respectivamente.
Propiedades intensivas o específicas de la materia.
Estas propiedades no las presentan todos los cuerpos, ya que no dependen de la cantidad de masa, son importantes porque permiten distinguir a un cuerpo de otro. Pueden ser físicas como: la densidad, la tenacidad, la conductividad eléctrica y calorífica, la elasticidad, maleabilidad, cambios de estado o químicas como: la fuerza oxidante, la acidez o basicidad, combustibilidad, capacidad de combinación (valencia), electronegatividad. Tratando de que estos conceptos queden claros a continuación se mencionan los definiciones de cada una de las propiedades mencionadas.
- Tenacidad: Es la resistencia de un cuerpo a ser fracturado.
- Densidad: Es la relación que existe entre la masa y el volumen de un cuerpo.Su expresión matemática es: d=m/v. Cada sustancia posee una densidad única y no depende de la cantidad de masa y es diferente para cada sustancia.
| Elementos químicos de la A-B | |||||
| No. | Nombre | Símbolo | Densidad | P. E. | P. F. |
| 1 | Actinio | Ac | 10,07 | 3300 | 1050 |
| 2 | Aluminio | Al | 2,7 | 2450 | 660 |
| 3 | Americio | Am | 13,67 | 2600 | 994 |
| 4 | Antimonio | Sb | 6,68 | 1380 | 630,5 |
| 5 | Argón | Ar | 1,40 | -185,8 | -189,4 |
| 6 | Arsénico | As | 5,73 | 613 | 817 |
| 7 | Astato | At | No reportada | 350 | 300 |
| 8 | Azufre | S | 2,33 | 444,6 | 119,0 |
| 9 | Bario | Ba | 3,5 | 1640 | 714 |
| 10 | Berilio | Be | 1,85 | 2770 | 1278 |
| 11 | Berquelio | Bk | 14,78 | 2660 | 1140 |
| 12 | Bismuto | Bi | 9,8 | 1560 | 271 |
| 13 | Boro | B | 2,34 | 3865 | 2080 |
| 14 | Bromo | Br | 3,12 | 58,78 | -7,25 |
| 15 | Cadmio | Cd | 8,65 | 765 | 321 |
| 16 | Calcio | Ca | 1,55 | 1440 | 839 |
| 17 | Californio | Cf | No reportada | 1490 | 900 |
| 18 | Carbono | C | 2,62 | 4830 | 3727 |
| 19 | Cerio | Ce | 6.78 | 3468 | 796 |
| 20 | Cesio | Cs | 1,87 | 690 | 28,4 |
| 21 | Circonio | Zr | 6,49 | 3580 | 1852 |
| 22 | Cloro | Cl | 1,56 | -34,05 | -101 |
| 23 | Cobalto | Co | 8,9 | 2900 | 1495 |
| 24 | Cobre | Cu | 8,96 | 2595 | 1083 |
| 25 | Criptón | Kr | 2,6 | -152 | -157,3 |
| 26 | Cromo | Cr | 7,19 | 2665 | 1875 |
| 27 | Curio | Cm | 13,5 | 3540 | 1340 |
| 28 | Disprosio | Dy | 8,54 | 2600 | 1407 |
| 29 | Einstenio | Es | No reportada | No reportada | No reportada |
| 30 | Erbio | Er | 9,1 | 2900 | 1497 |
| 31 | Escandio | Sc | 3,0 | 2730 | 1539 |
| 32 | Estaño | Sn | 7,30 | 2270 | 232 |
| 33 | Estroncio | Sr | 2,6 | 1380 | 768 |
| 34 | Europio | Eu | 5,26 | 1439 | 826 |
| 35 | Fermio | Fm | 1,69 | No reportado | No reportado |
| 36 | Flúor | F | 1,505 | -188,13 | -219,61 |
| 37 | Fósforo | P | 1,82 | 280 | 44,1 |
| 38 | Francio | Fr | No reportada | 677 | 27 |
| 39 | Gadolinio | Gd | 7,89 | 3273 | 1313 |
| 40 | Galio | Ga | 5,91 | 2403 | 30 |
| 41 | Germanio | Ge | 5,32 | 2830 | 937 |
| 42 | Hafnio | Hf | 13,1 | 4602 | 2227 |
| 43 | Hahnio | Ha | No reportada | No reportado | No reportado |
| 44 | Helio | He | 0,126 | -268,9 | -272,2 |
| 45 | Hidrógeno | H | 0,08988 | -252,87 | -255,34 |
| 46 | Hierro | Fe | 7,86 | 2750 | 1535 |
| 47 | Holmio | Ho | 8,8 | 2700 | 1474 |
| 48 | Indio | In | 7,31 | 2080 | 157 |
| 49 | Iridio | Ir | 22,5 | 4130 | 2410 |
| 50 | Iterbio | Yb | 6,98 | 1196 | 819 |
| 51 | Itrio | Y | 4,5 | 3338 | 1522 |
| 52 | Lantano | La | 6,7 | 3464 | 918 |
| 53 | Laurencio | Lr | No reportada | No reportado | No reportado |
| 54 | Litio | Li | 0,53 | 1342 | 181 |
| 55 | Lutecio | Lu | 9,84 | 3402 | 1663 |
| 56 | Magnesio | Mg | 1,74 | 1107 | 649 |
| 57 | Manganeso | Mn | 7,43 | 962 | 1245 |
| 58 | Mendelevio | Md | No reportada | No reportado | No reportado |
| 59 | Mercurio | Hg | 13,53 | 356,58 | -38,87 |
| 60 | Molibdeno | Mo | 10,22 | 5560 | 2610 |
| 61 | Neodimio | Nd | 7,01 | 3074 | 1021 |
| 62 | Neón | Ne | 1,20 | -246,08 | -248,6 |
| 63 | Neptunio | Np | 20,4 | 3902 | 630 |
| 64 | Niobio | Nb | 8,55 | 4742 | 2468 |
| 65 | Níquel | Ni | 8,91 | 2732 | 1453 |
| 66 | Nitrógeno | N | 1,2506 | -196 | -210 |
| 67 | Nobelio | No | No reportada | No reportado | No reportado |
| 68 | Oro | Au | 19,3 | 2970 | 1064,4 |
| 69 | Osmio | Os | 22,4 | 5027 | 3030 |
| 70 | Oxígeno | O | 1,43 | -182,96 | -218,4 |
| 71 | Paladio | Pd | 12,02 | 2970 | 1554 |
| 72 | Plata | Ag | 10,50 | 2212 | 961,93 |
| 73 | Platino | Pt | 21,4 | 3827 | 1772 |
| 74 | Plomo | Pb | 11,4 | 1740 | 328 |
| 75 | Plutonio | Pu | 19,84 | 3235 | 641 |
| 76 | Polonio | Po | 9,4 | 962 | 254 |
| 77 | Potasio | K | 0,86 | 760 | 63 |
| 78 | Praseodimio | Pr | 6,77 | 3520 | 931 |
| 79 | Promecio | Pm | 6,475 | 3000 | 1042 |
| 80 | Protactinio | Pa | 15,4 | 4227 | 1552 |
| 81 | Radio | Ra | 5,5 | 1140 | 700 |
| 82 | Radón | Rn | 9,91 | -62 | -71 |
| 83 | Renio | Re | 20,53 | 5627 | 3180 |
| 84 | Rodio | Rh | 12,41 | 3727 | 1966 |
| 85 | Rubidio | Rb | 1,53 | 686 | 38,89 |
| 86 | Rutenio | Ru | 12.2 | 3900 | 2310 |
| 87 | Rutherfordio | Rf | No reportada | No reportado | No reportado |
| 88 | Samario | Sm | 7,54 | 1794 | 1074 |
| 89 | Selenio | Se | 4,79 | 685 | 50 |
| 90 | Silicio | Si | 2,33 | 2355 | 1410 |
| 91 | Sodio | Na | 0,97 | 883 | 98 |
| 92 | Talio | Tl | 11,85 | 1457 | 304 |
| 93 | Tántalio | Ta | 16,6 | 5425 | 2996 |
| 94 | Tecnecio | Tc | 11,5 | 4567 | 2200 |
| 95 | Teluro | Te | 6,24 | 990 | 452 |
| 96 | Terbio | Tb | 8,27 | 3230 | 1356 |
| 97 | Titanio | Ti | 4,5 | 3287 | 1660 |
| 98 | Torio | Th | 11,7 | 4850 | 1750 |
| 99 | Tulio | Tm | 9,33 | 1950 | 1545 |
| 100 | Tungsteno | W | 19,3 | 5660 | 3410 |
| 101 | Uranio | U | 18,90 | 3818 | 1132 |
| 102 | Vanadio | V | 5,8 | 3380 | 1890 |
| 103 | Xenón | Xe | 3,06 | -108,1 | -111,8 |
| 104 | Yodo | I | 4,92 | 185 | 113,6 |
| 105 | Zinc | Zn | 7,14 | 907 | 420 |
- Conductividad eléctrica: Es la capacidad de los materiales de conducir corriente eléctrica.
- Oxidación: Facilidad de una sustancia para perder electrones.
- Acidez: Es la característica que presentan ciertas sustancias para ceder protones.
- Elasticidad: Es la facilidad de un cuerpo para estirarse por una fuerza y volver a recuperar su forma al desaparecer esa fuerza. Este fenómeno lo observamos cuando estiramos una liga.
- Magnetismo: Fenómeno que presentan ciertos cuerpos de ser atraídos por un campo magnético.
- Maleabilidad : Facilidad de ciertos materiales para poder moldearse.
- Combustibilidad: Es la capacidad de ciertas sustancias para poder arder fácilmente.
- Electronegatividad: Fuerza para atraer electrones por parte de un elemento durante la formación de un enlace.
- En la naturaleza los diversos materiales se presentan en forma de:
- Sustancias puras. Dentro de esta presentación tenemos a los elementos y los compuestos.
Un elemento es aquella sustancia que no puede descomponerse por métodos químicos en otra más sencilla. Los elementos conocidos se encuentran clasificados en la tabla periódica en total son 105.
Los Compuestos resultan de la combinación de 2 o más elementos en una proporción definida, los elementos unidos pierden sus propiedades individuales . Los compuestos pueden separarse por métodos químicos. Ejemplos: NaCl, CO2,HCl etcétera.
- Mezclas . Son sistemas que se forman por la combinación física de elementos o compuestos en diferente proporción, los cuales conservan sus propiedades y se pueden separar por métodos físicos.
Por citar algunos ejemplos de mezclas tenemos:
- A las soluciones como: los refrescos, sueros.
- Los coloides como:la mayonesa y la gelatina.
- Las suspensiones como: jugos de frutas, y algunos medicamentos como el melox.
Dependiendo del número de fases que presentan las mezclas estas se dividen en:
- Mezclas homogéneas.
- Mezclas heterogéneas.
- Las mezclas donde se pueden distinguir sus componentes. Por ejemplo:
Agua +arena; la sangre; limaduras de hierro + azúcar. Estas mezclas se denominan mezclas heterogéneas o simplemente mezclas. - Las mezclas donde los componentes se unen hasta el nivel molecular de manera que no se distinguen sus componentes. Por ejemplo: Oxígeno en agua, orina, sal en agua. Estas son mezclas homogéneas o soluciones.
Las mezclas homogéneas presentan una fase y dentro de esta clasificación tenemos:
Soluciones, las cuales a su vez se subdividen en:
- Soluciones sólidas
- soluciones líquidas.
Las soluciones líquidas pueden ser a su vez:
- gas-líquido.
- sólido-líquido.
- líquido-líquido.
La materia se presenta básicamente en cuatro estados, los cuales son: sólido, líquido , gaseoso y plasma. En la siguiente tabla se muestran algunas características físicas de los 3 primeros estados de agregación de la materia.
| Estado de Agregación | Volumen | Forma | Compresibilidad | Atracción entre moléculas |
| Sólido | Definido | Definida | Incomprensible | Intensa |
| Líquido | Definido | Indefinida | Incomprensible | Moderada |
| Gas | Indefinido | Indefinida | Compresible | Despreciable |
Estado sólido. Es un estado de la materia en el cual las partículas ocupan posiciones fijas dándole a la sustancia una forma definida. Los sólidos comúnmente tienen unidad similar. Presentan enlaces muy fuertes por esa razón no tienen movilidad. Se presentan en dos formas las cuales son:
a. Cristalinos. Estos sólidos tienen punto de fusión único. Ejemplo: NaCl
b. Amorfos. Son sólidos que no tienen punto de fusión único. Ejemplos: plástico, vidrios y geles.
PROPIEDADES DE LOS LÍQUIDOS.
Este estado de agregación tiene las siguientes propiedades:
- Viscosidad. Resistencia fluir libremente es decir al flujo.
- Tensión Superficial. Atracción de las moléculas en la superficie.
- Presión de vapor Habilidad de las moléculas para escapar del líquido.
- Punto de ebullición. Cuando la presión de vapor es igual a la presión atmosférica.
CARACTERÍSTICAS DEL ESTADO GASEOSO.
- En este estado las partículas tienen suficiente energía para vencer la fuerza de atracción de las otras.
- Cada partícula esta completamente separada de las otras.
- Tienen densidades bajas ya que los gases ocupan completamente el recipiente que los contiene.
Es considerado como el cuarto estado de la materia, pues su presencia en el universo es muy abundante. Se trata de una masa gaseosa fuertemente ionizada en la cual, como consecuencia de temperaturas extremadamente elevadas, los átomos se han visto despojados de su envoltura de electrones y coexisten con los núcleos atómicos en un estado de agitación intensa. Las estrellas, durante una parte importante de su vida, están constituidas por grandes masas de plasma. Debido a la violencia de los choques entre núcleos, en tales condiciones se producen reacciones de síntesis de núcleos nuevos con una considerable liberación de energía. El Sol es esencialmente una enorme esfera de plasma.
CAMBIOS DE ESTADO.
Cuando una sustancia cambia de estado ese cambio implica suministro o liberación de energía del sistema. Por esa razón los cambios de estado pueden ser de dos tipos.
- Endotérmicos. Son cambios de estado que se originan cuando al sistema se le administra energía.
- Exotérmicos. Cambios de estado que se originan cuando el sistema desprende energía.
- Sublimación. Es un cambio de estado directo de sólido a gas. Ejemplos: La sublimación del Iodo, Hielo seco (CO2 sólido).
El proceso inverso, o sea cuando una sustancia en estado gaseoso solidifica, sin pasar por el estado líquido, se llama deposición mediante este método se obtiene la naftalina. - Fusión. Es un cambio de estado que permite que una sustancia en estado sólido pase al estado líquido. Ejemplos: hielo derritiéndose, la mantequilla derretida en un sartén, un chocolate derretido en la palma de la mano.
- Solidificación. Es un cambio de estado que ocurre cuando un liquido pasa al estado sólido. Ejemplos: La nieve , la formación de figuras de cera , la obtención de figuras de plástico.
- Evaporización. Es cambio de estado endotérmico que permite que una sustancia en estado líquido pase al estado gaseoso.
- Condensación. Es la conversión del estado de vapor al estado líquido. Este proceso es el inverso de la evaporización.
Ejemplo. Empañamiento de una ventana. - Licuefacción. Es el paso del estado gaseoso al estado líquido. Ejemplos. La obtención de aire líquido o de alguno de sus componentes.
- Cristalización. Proceso por el cual se forman cristales. Hay formación de cristales cuando una sustancia se enfría. Este proceso se observa cuando se tiene un sólido disuelto en una disolución saturada.

![pH= -\log a_{H^+} \approx -\log [H^+]\,](http://upload.wikimedia.org/math/a/4/2/a42af9259f73d916979c0835248bf751.png)






No hay comentarios:
Publicar un comentario